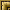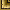Моноцитарный хемоаттрактивный протеин-1 (MCP-1) в патогенезе изменений тубулоинтерстициальной ткани у детей с хроническим гл оме рул о нефритом
НЦЗД РАМН, г. Москва
Ключевые слова: тубулоинтерстициальные изменения, моноцитарный хемоаттрактивный протеин-1
Абстракт.
С целью исследования моноцитарного хемоаттрактивного протеина-1 (МСР-1) в патогенезе тубуло-интерстициальных изменений обследованы 16 детей с хроническим гломерулонефритом и 5 детей с хроническими интерстициальными заболеваниями. Контрольная группа была представлена 8 практически здоровыми детьми. У всех детей определялись уровни МСР-1 в моче, а у пациентов с хроническим гломерулонефритом - и в сыворотке крови методом твердофазного энзим-связанного иммуносорбентного анализа. Содержание МСР-1 в моче оценивалось по соотношению уровней в моче указанного цитокина и креатинина (протеин-креатининовому коэффициенту). Установлена существенная роль МСР-1 в патогенезе тубулоинтерстициальных изменений как локального медиатора, образованного непосредственно в почечной ткани. Обоснована целесообразность определения протеин-креатининового коэффициента в моче с целью диагностики степени тубулоинтерстициального повреждения.
In order to investigate the role of monocyte chemoattractant protein-1 (MCP-1, chemoattractant cytokine for main cells in the composition of renal interstitial infiltrations) in pathogenesis of tubulointerstitial changes we examined 16 children with chronic glomerulonephritis and 5 children with chronic interstitial nephriris. In all of them the urine levels of MCP-1 was measured. In children with chronic glomerulonephritis the blood levels of this cytokine was also measured by immunoenzyme assay. Urine concentration of MCP-1 was estimated by calculation the correlation of the urine levels of MCP-1 and creatinine (protein-creatinine coefficient). We revealed the definite role of MCP-1 in pathogenesis of tubulointerstitial changes as local messengers, formed directly in renal tissue, and found that the urine protein-creatinine coefficient is useful for definition of the degree of tubulointerstitial damage.
Тубулоинтерстициальная ткань играет определяющую роль в функционировании почки в физиологических и патологических условиях. Согласно современным представлениям тубулоинтерстициальное повреждение является важнейшим фактором прогрессирования хронического гломерулонефрита и обуславливает нарушения как собственно канальцевых функций, так и клубочковой фильтрации уже на ранних сроках заболевания [4-6, 8-10, 21, 26]. Указанные факты обосновывают необходимость изучения патогенеза тубулоинтерстициальных изменений. По суще-ствующим в настоящее время данным процесс повреждения тубулоинтерстициальной ткани включает три взаимосвязанных этапа: инфильтрацию почечного интерстиция воспалительными клетками, развитие интерстициального фиброза и формирование тубулярной атрофии [12, 27].
Ключевое событие на первом (индукционном) этапе тубулоинтерстициальных изменений - повреждение в результате имеющих место при гломерулонефрите тубулярной ишемии и протеинурии проксимальных канальцевых клеток. Согласно современным представлениям эти клетки являются основным источником цитокинов и факторов роста, опосредующих межклеточные взаимодействия в патогенезе изменений ренальной ткани. В качестве ключевого из этих цитокинов в патогенезе тубулоинтерстициального повреждения в настоящее время рассматривают моноцитарный хемоаттрактивный протеин-1 (monocyte chemoattractant protein-1, MCP-1). Значение МСР-1 в развитии тубулоинтерстициальных изменений связано с его способностью привлекать в интерстициальную ткань моноциты - основные клетки в составе инфильтратов почечного интерстиция [2, 11, 13, 14, 16, 17, 20, 22-24, 28, 29, 31, 32, 34-36]. Доминантную роль MCP-1 в этом процессе подтверждают данные об уменьшении на 80% миграции моноцитов при нейтрализации указанного цитокина [24].
Установлено, что MCP-1 экспрессируют главным образом тубулярные, а не гломерулярные клетки. Обнаружено, что именно этот цитокин опосредует в первую очередь повреждение канальцев и интерстиция, а не гломерул, способствуя накоплению вблизи клеток канальцевого эпителия активированных макрофагов, повреждающих тубулярные клетки [35, 36]. В немногочисленных исследованиях обнаружен повышенный уровень MCP-1 в моче и, в меньшей степени, плазме крови как в экспериментальных моделях, так и у взрослых больных с выраженными тубулоинтерстициальными изменениями; выявлена корреляция экскреции с мочой указанного цитокина с уровнем протеинурии и степенью тубулоинтерстициального повреждения [18, 19, 25, 30, 37]. В то же время следует отметить, что клинических наблюдений, касающихся участия МСР-1 в патогенезе хронического гломерулонефрита, мало, исследования у детей - единичные. Комплексного исследования этого цитокина в крови и моче с расчетом протеин-креатининового коэффициента в зависимости от степени тубулоинтерстициального повреждения при хроническом гломерулонефрите у детей в литературе не обнаружено. Вышеуказанное обусловило проведение настоящей работы.
Цель нашего исследования - установить роль МСР-1 в патогенезе тубулоинтерстициального повреждения у детей с хроническими заболеваниями почек.
Материалы и методы
Обследованы 29 детей: 16 больных с хроническим гломерулонефритом, 5 пациентов с первично интерстициальными заболеваниями (аутосомно-доминантным типом поликистоза почек и хроническим интерстициальным нефритом), 8 практически здоровых детей контрольной группы.
У 11 из 16 детей с хроническим гломерулонефритом имел место нефротический синдром в сочетании с гематурией и/или артериальной гипертензией. В связи со стероид-резистентностью у этих больных была проведена пункционная нефробиопсия, по данным которой обнаружен фокально-сегментарный гломерулосклероз с тубулоинтерстициальным повреждением. Изменения тубулоинтерстициальной ткани, в соответствии с классификацией В.В. Ставской, были представлены умеренными (n = 5) и выраженными (n = 6) [7]. Согласно классификации М.Я. Ратнер, у описанных детей имели место прогностически неблагоприятные клинический и морфологический типы заболевания [3]. У 5 детей с хроническим гломерулонефритом, включенных в исследование, отмечен стероид-зависимый нефротический синдром. Согласно вышеуказанной классификации у этих больных имел место прогностически благоприятный клинический тип заболевания [3]. Все пациенты обследовались в активную стадию заболевания на фоне иммуносупрессивной терапии.
У всех детей с ренальными заболеваниями имело место снижение функции почек по осмотическому концентрированию, у 3 - ограничение клубочковой фильтрации. Последнее отмечено у одного ребенка с умеренными изменениями тубулоинтерстициальной ткани по данным нефробиопсии, у одного - с выраженным тубулоинтерстициальным повреждением и у одного ребенка с хроническим интерстициальным нефритом.
Определение уровней MCP-1 проведено методом твердофазного энзим-связанного иммуносорбентного анализа в сыворотке крови и моче у практически здоровых детей и у больных с хроническим гломерулонефритом, в моче - у пациентов с первично интерстициальными заболеваниями. Содержание МСР-1 в моче оценено по соотношению уровней указанного цитокина (пг/мл) и креатинина (ммоль/л) (протеин-креатининовому коэффициенту, пг/ммоль креатинина) во второй утренней порции мочи (для удобства расчетов значения протеин-креатининового коэффициента разделены на 1000).
У детей с прогностически неблагоприятными типами гломерулонефрита анализ содержания МСР-1 в крови и моче проведен в зависимости от степени тубулоинтерстициальных изменений. С целью уточнения возможного влияния прогностически неблагоприятных типов заболевания на уровень МСР-1 в крови и моче проведен сравнительный анализ его показателей у детей вышеуказанной группы и у пациентов со стероид-зависимым нефротическим синдромом, поскольку у последних, как правило, отмечаются прогностически благоприятные типы заболевания и невыраженные (незначительные и умеренные изменения тубулоинтерстициальной ткани) [1, 32]. Группа детей с первично интерстициальными заболеваниями включена в исследование для подтверждения существенной роли МСР-1 непосредственно в повреждении тубулоинтерстициальной ткани.
Результаты и обсуждение
При исследовании крови уровень МСР-1 у детей контрольной группы составил 325,6 + 48,38 пг/мл.
У больных с прогностически неблагоприятными типами гломерулонефрита и выраженными изменениями тубулоинтерстициальной ткани повышение уровня МСР-1 обнаружено в 83,3% случаев (у пяти из шести детей указанной группы). Колебания уровня изучаемого цитокина в сыворотке крови у пациентов этой группы составили от 340 до 900 пг/мл, выявлено существенное по сравнению с контрольным значением повышение среднего уровня MCP-1: 519,33 + 196,81 пг/мл, р< 0,027.
У детей с прогностически неблагоприятными типами гломерулонефрита и умеренными тубулоинтерстициальными изменениями повышение уровня МСР-1 в сыворотке крови обнаружено только в 20% случаев (у одного ребенка из пяти детей указанной группы). Колебания сывороточного уровня МСР-1 в этой группе составили от 300 до 480 пг/мл, в среднем 378 + 81,36 пг/мл. Достоверных изменений изучаемого показателя по сравнению с его значением у здоровых детей не обнаружено. Как средний уровень МСР-1, так и частота случаев повышения указанного показателя в сыворотке крови у пациентов с умеренными изменениями тубулоинтерстициальной ткани представляются более низкими, чем у больных с выраженным тубулоинтерстициальным повреждением, однако статистически достоверных различий нами не обнаружено, что, возможно, связано с небольшим числом наблюдений.
Подобные вышеописанным результатам (у детей с прогностически неблагоприятными типами гломерулонефрита и умеренными изменениями тубулоинтерстициальной ткани) данные получены и при определении уровня MCP-1 у пациентов со стероид-зависимым нефротическим синдромом. Повышение уровня МСР-1 в сыворотке крови выявлено в 40% случаев (у двух из пяти детей указанной группы). Колебания уровня изучаемого цитокина в сыворотке крови у этих пациентов составили от 290 до 416 пг/мл, в среднем 360,8 ± 49,69 пг/мл. Достоверных изменений сывороточного уровня MCP-1 у пациентов со стероид-зависимым нефротическим синдромом по сравнению с его значением у здоровых детей не выявлено. Не обнаружено и существенных различий средних уровней указанного цитокина в сыворотке крови у больных со стероид-зависимым нефротическим синдромом по сравнению с показателем у пациентов с выраженным повреждением тубулоинтерстициальной ткани (рис. 1).
При изучении экскреции МСР-1 с мочой протеин-креатининовый коэффициент у здоровых детей составил 10,1 + 1,39 пг/ммоль креатинина.
Повышение экскреции МСР-1 с мочой выявлено у всех детей с хроническими заболеваниями почек. Наиболее высокие значения - протеин-креатининовый коэффициент от 37,6 до 120,8 пг/ммоль креатинина, в среднем 76,37 ± 33,76 пг/ммоль креатинина -обнаружены у детей с хроническим гломерулонефритом при выраженных изменениях тубулоинтерстициальной ткани. У пациентов со стероид-резистентным нефротическим синдромом и умеренными тубулоинтерстициальными изменениями колебания изучаемого показателя составили от 13,9 до 46,5 пг/ммоль креатинина, в среднем 35,54 + 12,89 пг/ммоль креатинина. И при выраженных, и при умеренных изменениях тубулоинтерстициальной ткани средние значения экскреции МСР-1 с мочой существенно превышали тот же показатель контрольной группы: р < 0,006 и р < 0,009 соответственно. Выявлена достоверная разница в средних уровнях экскреции МСР-1 с мочой в зависимости от степени тубулоинтерстициальных изменений: у детей с выраженным тубулоинтерстициальным повреждением этот показатель был существенно выше, чем у пациентов с умеренными изменениями тубулоинтерстициальной ткани, р < 0,018. В группе детей со стероид-зависимым нефротическим синдромом экскреция МСР-1 приближалась к ее значениям у детей со стероид-резистентным нефротическим синдромом и умеренными тубулоинтерстициальными изменениями: 14-45,4 пг/ммоль креатинина, в среднем 35,15 + 12,45 пг/ммоль креатинина. Средний уровень экскреции изучаемого цитокина с мочой у детей со стероид-зависимым нефротическим синдромом существенно превышал показатель в контрольной группе - р < 0,009, но был значительно ниже, чем у детей с хроническим гломерулонефритом при выраженных тубулоинтерстициальных изменениях -р< 0,018.
Рис. 1. Уровень хемотаксического для моноцитов белка-1 в сыворотке крови у детей с хроническим гломерулонефритом (пг/мл); * - различия достоверны по сравнению с контрольной группой, р < 0,027

Уровень экскреции МСР-1 с мочой у детей с первично интерстициальными заболеваниями - протеин-креатининовый коэффициент 40,6-110,3 пг/ммоль креатинина, в среднем 69,83 + 26,68 пг/ммоль креатинина - приближался к показателю у пациентов с хроническим гломерулонефритом, сопровождающимся выраженными тубулоинтерстициальными изменениями. Среднее значение экскреции МСР-1 с мочой у больных с первично интерстициальными заболеваниями было существенно выше, чем у пациентов с хроническим гломерулонефритом при умеренных изменениях тубулоинтерстициальной ткани -р < 0,028, у детей со стероид-зависимым нефротическим синдромом - р < 0,028 и в контрольной группе -р < 0,009 (рис. 2).
Таким образом, полученные результаты указывают на существенное увеличение уровня MCP-1 в моче и крови у детей с хроническими заболеваниями почек
Поскольку проксимальные канальцевые клетки, поврежденные посредством протеинурии и/или тубулярной ишемии, являются основным источником цитокинов и факторов роста, значительное повышение содержания МСР-1 в моче по мере возрастания тяжести тубулоинтерстициальных изменений связано, вероятно, с его эффектами как локального медиатора, образованного непосредственно в почечной ткани и опосредующего тубулоинтерстициальное повреждение. Это подтверждают и данные, полученные у детей с интерстициальными заболеваниями. Достоверно более низкие значения МСР-1 при «невыраженных» тубулоинтерстициальных изменениях, независимо от присутствия прогностически неблагоприятных типов заболевания, по сравнению с его уровнем у детей с наиболее тяжелым повреждением канальцев и интерстиция, в свою очередь, указывают на участие изучаемого цитокина в повреждении преимущественно тубулоинтерстициальной ткани. В связи с тем, что моноциты являются основными клетками в составе инфильтратов почечного интерстиция, изменение уровня MCP-1 в моче, по-видимому, следует считать наиболее специфичным по сравнению с другими цитокинами для тубулоинтерстициального повреждения. Это положение подтверждают и результаты проведенных ранее и упомянутых выше исследований [18, 19, 24, 25, 30, 35-37].
Рис. 2. Уровень хемотаксического для моноцитов белка-1 в моче у детей с хроническими заболеваниями почек (протеин-креатининовый коэффициент, пг/ммоль креатинина); * - различия достоверны по сравнению с показателями в других группах: у детей с прогностически неблагоприятными типами гломерулонефрита и выраженными тубулоинтерстициальными изменениями - р < 0,006, у детей с прогностически неблагоприятными типами гломерулонефрита и умеренными тубулоинтерстициальными изменениями, у детей со стероид-зависимым нефротическим синдромом и у пациентов с первично интерстициальными заболеваниями - p < 0,009; ** - различия достоверны по сравнению с показателями у детей с прогностически неблагоприятными типами гломерулонефрита и выраженными тубулоинтерстициальными изменениями (p < 0,018) и у детей с первично интерстициальными заболеваниями (p < 0,028)

Заключение
Таким образом, результаты проведенного исследования подтверждают ключевое значение MCP-1 в повреждении тубулоинтерстициальной ткани при хроническом гломерулонефрите у детей. Повышение экскреции МСР-1 с мочой и увеличение его уровня в сыворотке крови по мере возрастания тяжести тубулоинтерстициальных изменений указывают на целесообразность определения этого цитокина в моче и крови с целью диагностики степени тубуло-интерстициального повреждения. Поскольку изменения тубуло-интерстициальной ткани являются одним из существенных факторов прогрессирования хронического гломерулонефрита, определение МСР-1 - ключевого медиатора тубулоинтерстициального повреждения -может быть использовано для прогноза течения заболевания. Наиболее достоверным диагностическим тестом следует считать соотношение содержания в моче MCP-1 и креатинина - протеин-креатининовый коэффициент. Отсутствие необходимости в использовании сложных методик, высокая чувствительность и «неинвазивность» указанного исследования позволяют широко применять его в клинической практике.
Список литературы:
- Папаян А.В., Савенкова Н.Д, Калиничева Е.О. Хронический гломерулонефрит. В кн.: Папаян А.В, Савенкова НД Клиническая нефрология детского возраста. СПб.: СОТИС, 1997: 310-332.
- Ратнер М.Я. Современные представления о значении медиаторов в патогенезе фиброза почечного интерстиция. Тер. архив 1997; 12: 87-88.
- Ратнер М.Я., Серов В.В., Стенина И.И., Варшавский В.А., Розенфельд Б.И., Бродский М.А. О возможности предсказания морфологических типов при хроническом гломерулонефрите на основании клинико-функциональных данных. Клин. мед. 1988; 10: 119-124.
- Ратнер М.Я., Стенина И.М., Федорова Н.Д. Прогнозирование ускоренного прогрессирования хронического гломерулонефрита на основании клинических и гистоморфологических данных. Тер. архив 1999; 6: 27-30.
- Ратнер М.Я., Федорова Н.Д. Гистоморфологические тубулоинтерстициальные изменения при прогрессировании хронического гломерулонефрита. Урология 2000; 1: 28-30.
- Сергеева Т.В.,Алексеевских Ю.Г., Гозалишвили Т.В.,Раздолькина Т.И., Усубалиева А.Ж. Характер и значение тубулоинтерстициальных изменений при первичном гломерулонефрите у детей. Педиатрия 1997; 2: 49-52.
- Ставская В.В., Рябое С.И., Клемина И.Л. О клиническом значении тубулоинтерстициальных изменений при хроническом гломерулонефрите. Клин. мед. 1987; 10: 125-129.
- Berg U.B., Bohman S.O, Widstam-Attorps U. Renal histological changes in relation to renal function and urinary protein excretion in IgA nephropathy. Arch Dis Child 1991; 66; 5: 593-597.
- Bohle A., Mackensen-Haen S., von-Gise H. et al. The consequences of tubulointerstitial changes for renal function in glomerulopathies. A morphometric and cytological analysis. Pathol Res Pract 1990; 186; 1: 135-144.
- Bohle A., Strutz F., Muller G.A. On the pathogenesis of chronic renal failure in primery glomerulopathies: a view from the interstitium. Exp Nephrol 1994; 2: 205-210.
- Bottinger E.P., Bitzer M. TGF-beta signaling in renal disease. J Am Soc Nephrol 2002; 13; 10: 2600-2610.
- Burton C.Y., Walls Y. Interstitial inflammation and scarring: messages from the proximal tubular cell. Nephrol Dial Transplant 1996; 11: 1505-1508.
- Burton C.Y., Walls Y. Proximal tubular cell, proteinuria and tubulointerstitial Scarring. Nephron 1994; 68: 287-293.
- Daha M., van Kooten C. Is the proximal tubular cell a proinflammatory cell? Nephrol Dial Transplant 2000; 15 (Suppl. 6): 41-43.
- DAmico G. Influence of clinical and histological features on actuarial renal survival in adult patients with idiopathic IgA nephropathy, membranous nephropathy, and membranoproliferative glomerulonephritis: survey of the recent literature. Am J Kidney Dis 1992; 20; 4: 315-323.
- De Heer E., Sijpkens W., Verkade M. et al. Morphometry of interstitial fibrosis. Nephrol Dial Transplant 2000; 15 (Suppl. 6): 72-73.
- Frisyberg Y., Kelly C.J. TGFp and regulation of interstitial nephritis. Miner Electrolyte Metabol 1998; 24; 2-3: 181-189.
- Grandaliann G., Gesualdo L., Ranieri E. et al. Monocyte chemotactic peptide-1 expression in acute and chronic human nephritides: a pathogenic role in interstitial monocytes recruitment. J Am Soc Nephrol 1996; 7; 6: 906-913.
- Grandaliano G., Gesualdo L., Bartoli F. et al. MCP-1 and EGF-renal expression and urine excretion in human congenital obstructive nephropathy. Kidney Int 2000; 58; 1: 182-192.
- Honkanen E., Teppo A.M., Tornroth J. et al. Urinary TGF-p in membranous glomerulonephritis. Nephrol Dial Transplant 1997; 12; 12: 2562-2568.
- Hruby Z., Smolska D., Filipowski H. et al. The importance of tubulointerstitial injury in the early of primary glomerular disease. J Intern Med 1998; 243; 3: 215-222.
- Isaka Y., Tsujie M., Ando Y. et al. Transforming growth factor-beta 1 antisense oligodeoxynucleotides block interstitial fibrosis in unilateral ureteral obstruction. Kidney Int 2000; 58; 5: 1885-1892.
- Junker U., Haufe C.C., Nuske K. et al. Elevated plasma TGF-beta1 in renal diseases: cause or consequence? Cytokine 2000; 12; 7: 1084-1091.
- Kuroiwa T., Schlimgen R., Illei G.G. et al. Distinct Tcell/renal tubular epithelial cell interactions define differential chemokine production: implications for tubulointerstitial injury in chronic glomerulonephritides. J Immunol 2000; 164; 6: 3323-3329.
- Morii T., Fujita H., Narita T. et al. Association of monocyte chemoattractant protein-1 with renal tubular damage in diabetic nephropathy. J Diabetes Complications 2003; 17; 1: 11-15.
- Muller G.A., Zeisberg M., Strutz F. The importance of tubulointerstitial damage in progressive renal disease. Nephrol Dial Transplant 2000; 15 (Suppl. 6): 76-77.
- Naiker I.P., Ramsaroop R., Somers S.R. et al. Leukocyte analysis of tubulointerstitial nephritis in primary membranoproliferative glomerulonephritis. Am J Kidney Dis 1996; 27; 3: 316-320.
- O’Donnell M.P. Renal tubulointerstitial fibrosis. New thoughts on its development and progression. Postgrad Med 2000; 108; 1: 159-162, 165, 171-172.
- Ogata Y., Ishidoya S., Fukuzaki A. et al. Upregulated expression of transforming growth factor-beta, type IV collagen, and plasminogen activator inhibitor-1 mRNA are decreased after release of unilateral ureteral obstruction. Tohoku J Exp Med 2002; 197; 3: 159-168.
- Okada H., Moriwaki K., Kalluri R. et al. Inhibition of monocyte chemoattractant protein-1 expression in tubular epithelium attenuates tubulointerstitial alteration in rat Goodpasture syndrome. Kidney Int 2000; 57; 3: 927-936.
- Ota T., Tamura M., Osajima A. et al. Expression of monocyte chemoattractant protein-1 in proximal tubular epithelial cells in a rat model of progressive kidney failure. J Lab Clin Med 2002; 140; 1: 43-51.
- Prodjosudjadi W., Gerritsma J.S.J., Klar-Mohamad N. et al. Production and cytokine mediated regulation of monocyte chemoattractant protein-1 by proximal tubular epithelial cells. Kidney Int 1995; 48: 1477-1486.
- Schmitt H., Bohle A., Reineke T. et al. Long-term prognosis of membranoproliferative glomerulonephritis type I. Significance of clinical and morphological parameters: an investigation of 220 cases. Nephron 1990; 55; 3: 242-250.
- Segerer S., Cui Y., Hudkins K.L. et al. Expression of the chemokine monocyte chemoattractant protein-1 and its receptor chemokine receptor 2 in human crescentic glomerulonephritis. J Am Soc Nephrol 2000; 11; 12: 2231-2242.
- Taal M.W., Zandi-Nejad K., Weening B. et al. Proinflammatory gene expression and macrophage recruitment in the rat remnant kidney. Kidney Int 2000; 58; 4: 1664-1676.
- Tesch G.H., Schwarting A., Rinoshita K. et al. Monocyte chemoattractant protein1 promotes macrophage-mediated tubular injury, but not glomerular injury in nephrotoxic serum nephritis. J Clin Invest 1999; 103; 1: 73-80.
- Wada T., Furuichi K., Sakai N. et al. Upregulation of monocyte chemoattractant protein-1 in tubulointerstitial lesions of human diabetic nephropathy. Kidney Int 2000; 58; 4: 1492-1499.